Kwasy
- Anastazja
- 31 мар. 2018 г.
- 2 мин. чтения
Обновлено: 19 февр. 2019 г.
Kwasy - produkty reakcji wody z tlenkami niemetali. Mają wzór o strukturze:

gdzie :
H - wodór
R - reszta kwasowa
n - liczba atomów wodoru równa wartościowości reszty kwasowej.
Wartościowość reszty kwasowej równa się liczbie poprzedzających ją atomów wodoru.
Otrzymywanie kwasów
Otrzymuje się je po rozpuszczeniu związku wodoru w wodzie, za pomocy elektrolizy, w wyniku syntezy albo używając aparatury destylacyjnej.
Schematy tworzenia kwasów:
1. tlenek niemetalu + woda -> kwas

2. związek niemetalu z wodorem --rozp. w wodzie--> kwas

3.sól 1 + kwas 1 --> sól 2 + kwas 2

Wzory kwasów
Kwasy beztlenowe
HCl - kwas chlorowodorowy
H2S - kwas siarkowodorowy
HI - kwas jodowodorowy
HBr - kwas bromowodorowy
H2Se - kwas selenowodorowy
HF - kwas fluorowodorowy
Kwasy tlenowe
H3BO3 - kwas borowy
H2CO3 - kwas węglowy
HNO2 - kwas azotowy (III)
HNO3 - kwas azotowy (V)
H4SiO4 - kwas krzemowy
H3PO4 - kwas fosforowy (V)
H2SO3 - kwas siarkowy (IV)
H2SO4 - kwas siarkowy (VI)
HClO - kwas chlorowy (I)
HClO2 - kwas chlorowy (III)
HClO3 - kwas chlorowy (V)
HClO4 - kwas chlorowy (VII)
Właściwości i zastosowanie kwasów
żrące
bezbarwne
ciecze ( kwas borowy, fosforowy (V), szczawiowy, cytrynowy - ciała stałe)
nieorganiczne i organiczne
reagują z metalami i tlenkami metali
barwią wskaźniki na czerwono (z wyjątkiem błękitu bromotymolowego, fenoloftaleiny)
kwasy mocne : jodowodorowy, chlorowodorowy, siarkowy (VI), azotowy (V).
kwas o średniej mocy : fosforowy (V)
kwasy słabe : siarkowodorowy, węglowy, azotowy (III), masłowy, mrówkowy.
KWASY BEZTLENOWE
1.Kwas solny (chlorowodorowy, in. zalzajer)
Bezbarwna, żrąca ciecz o dymiącym, nieprzyjemnym zapachu. Barwi papierek wskaźnikowy na czerwono. Jego maksymalne stężenie procentowe wynosi 37%.
Reaguje z metalami i ich tlenkami, tworząc chlorki w reakcji podwójnej wymiany.
Otrzymywanie:
I sposób:


II sposób :

Stosowany jest w produkcji tworzyw sztucznych i barwników, leków na niedokwasotę. Występuje w żołądku. pH = 1.
2. Kwas siarkowodorowy
Bezbarwna, nietrwała ciecz o zapachu zgniłych jaj. Ma maksymalne stężenie procentowe 0,4 %. Reaguje z metalami i ich tlenkami, tworząc siarczki i wydzielając wodór (metale).
Otrzymywanie:
I sposób:

II sposób:


Stosowany jest w kąpielach w uzdrowiskach przy leczeniu chorób zwyrodnieniowych stawów i skórnych. pH=3
3. Kwas jodowodorowy
Bezbarwna, żrąca ciecz o dymiącym zapachu. Jej d=2,9 g/cm3. Maksymalne stężenie procentowe wynosi 57%. Należy przechwywać w ciemnym miejscu, ponieważ utlenia się na powietrzu. Najmocniejszy ze wszystkich kwasów. Reaguje z metalami i ich tlenkami, tworząc jodki. Ma silne właściwości korodujące.
Otrzymywanie:


Stosowany jest w medycynie i w laboratoriach jako czynnik odkażający. pH=1
4.Kwas bromowodorowy
Bezbarwna, dymiąca ciecz. Rozkłada się pod wpływem temperatury 530 stopni na brom i wodór. Reaguje z metalami i ich tlenkami, tworząc bromki. Gęstość wynosi 1,5 g/cm3.
Otrzymywanie:
I sposób:

II sposób:
Synteza bromku potasu i kwasu siarkowego (VI)

Rozpuszczenie w wodzie bromowodoru

Stosowany jest przy otrymywaniu alkanów, alkenów i katalizuje reakcje chemczne.
pH=1
5. Kwas flouorowodorowy
Bezbarwna, dymiąca ciecz o duszącym zapachu. Trawi szkło, jest silnie żrąca. Reaguje z metalami i ich tlenkami, tworząc fluorki.
Otrzymywanie:
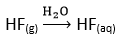
Stosuje się go w przemyśle petrochemicznym i do trawienia szkła. pH=2,5
cdn.




Комментарии